Coupe à froid : Cryo-Ultramicrotomie
L’ultramicrotomie à froid, appelé couramment Cryo-Ultramicrotomie permet l’obtention d’une lame mince d’épaisseur constante (de 30 à 150 nm) à partir de matériaux très mous ne pouvant être coupés à température ambiante. Elle a été mise au point par les biologistes et son utilisation s’étend aujourd’hui aux polymères et nous l’avons adaptée pour les matériaux hybrides et friables. Elle est basée sur la découpe d’un échantillon refroidi par le tranchant d’un couteau de diamant, également refroidi. Afin de durcir le matériau, il est refroidit jusqu’à une température proche de sa température de transition Tg (transition vitreuse), si celle-ci est connue. Les techniques de coupe à froid que nous avons utilisé, en fonction des spécificités de matériaux étudiés, ont été : i) la technique « à la membrane », méthode qui est développée spécifiquement pour les cristaux moléculaires, son développement et sa mise en place sont détaillés dans le chapitre 3, ii) la technique au diméthylsulfoxide (DMSO) qui permet de réaliser des coupes jusqu’à – 40°C tout en gardant le solvant dans la cuve du couteau à l’état liquide, iii) la méthode Tokuyasu, dans laquelle les coupes se font à -160°C et elles sont récupérées à l’aide d’une solution de sucrose et iv) la technique CEMOVIS qui permet de couper des sections à la température de l’azote liquide (-196°C) où, les coupes sont maintenues en lévitation à l’aide d’un champ électrostatique et puis on vient avec une grille à membrane de carbone pour les récupérer. Nous présentons ces trois dernières méthodes et le contexte dans le quelle nous les avons utilisées.
1) La technique au diméthylsulfoxide (DMSO)
La méthode avec le DMSO permet de conjuguer l’avantage de la réalisation d’une coupe dans les conditions standard et la réalisation de celle-ci à basse température. En effet, nous utilisons le couteau standard (figure 12A) remplie d’une solution de 40% de DMSO dans l’eau distillée. Cette solution reste liquide jusqu’à une température de – 40°C. Selon le matériau et ses caractéristiques physiques (mou à température ambiant, sa Tg) nous adaptons les températures de l’échantillon et du couteau. L’échantillon est directement refroidi à la température voulue dans l’enceinte du cryo-ultramicrotome qui contrôle la température grâce à un système qui utilise l’azote liquide pour refroidir et des résistances pour chauffer. Une fois la pyramide réalisée grâce au cryo-trimer (figure 11D), nous procédons à la coupe des sections et, selon le comportement de l’échantillon, nous adaptons les conditions de coupe (vitesse, angle, température) pour obtenir des sections sans artefacts. Les sections obtenues flottent en surface de la solution grâce aux tensions superficielles des molécules de surface et sont récupérées comme décrite dans la figure 11. Nous avons utilisé cette méthode dans certaines de nos études qui ont porté sur la caractérisation de matériaux mous (polymères) à température ambiante, donc impossible à caractériser par MET directement sans préparation préalable. Par exemple, nous avons étudié la distribution de nanoparticules de magnétites dans un polymère, le polypropylène (avec une Tg de –13°C), selon plusieurs protocoles d’inclusion.46 Pour réaliser cette étude, nous avons coupé des lames minces de 50 nm à –30°C en utilisant la technique de DMSO. Les résultats ont permis de mettre en évidence la méthode d’inclusion de nanoparticules dans le polymère qui a donné la meilleure distribution et qui empêchait la formation d’agrégat de magnétites. Les avantages du DMSO dilué dans l’eau sont la possibilité de réaliser des coupes à froid jusqu’à –40°C et d’être facilement éliminé par nettoyage grâce à sa grande solubilité dans l’eau ce qui permet d’éviter les phénomènes de contamination lors de l’observation des coupes.
Cette technique a été développée par Jacques Dubochet et ses collègues et elle est connue sous le nom de cryo-EM de sections vitrifiées (CEMOVIS).40 Cette technique de coupe est souvent associée à un refroidissement rapide de l’échantillon pour éviter la formation de cristaux de glace. Elle est surtout utilisée pour les matériaux biologiques, comme des cellules ou des bactéries, qui peuvent être observées par cryo-ME sous forme de sections ultrafines congelées hydratées. Les échantillons sont dans un premier temps cryo-fixés généralement par congélation sous haute pression, puis coupés en sections minces (entre 40 à 150 nm d’épaisseur) à l’aide d’un cryo-ultramicrotome. Dans notre cas, nous l’utilisons, après adaptation, selon l’échantillon étudié pour obtenir des sections fines qui sont très difficiles à obtenir autrement.
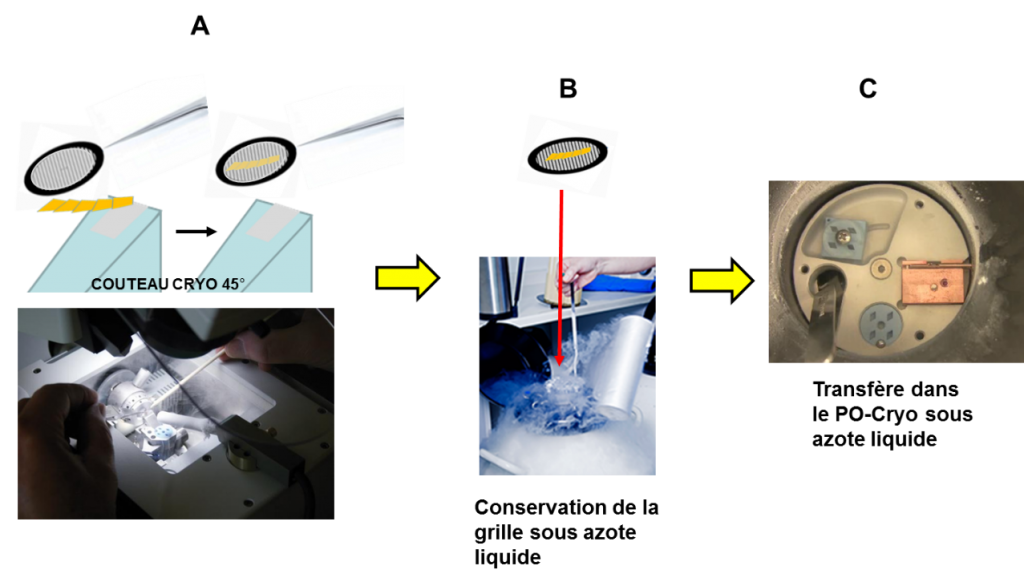
Par exemple, nous l’avons utilisée pour réaliser des coupes de 70 nm d’un cristal de moléculaire de fer et ruthénium pour mettre en évidence l’interface entre ces deux cristaux. En effet, ce matériau étant très sensible aux solvants, nous n’avons pas réussi à réaliser des coupes dans les conditions standards et ni avec la méthode au DMSO. Donc nous utilisons la méthode CEMOVIS, d’abord nous congelons rapidement ce cristal (1 mm2), et puis nous le fixons sur le porte-objet cryogénique du microtome dans la chambre du cryo-ultramicrotome préalablement refroidit à la température de l’azote (–196°C). Puis, le bloc est taillé directement en place, grâce au cryo-trimer (figure 11D). Pendant la réalisation des sections, celles-ci restent en lévitation grâce à un champ électrostatique par l’action d’un accessoire prévu à cet effet. L’étape finale de dépôt des sections sur la membrane de la grille consiste à utiliser une pince avec une grille MET que nous rapprochons des coupes qui viennent s’aplatir sur la grille après l’arrêt du champ électrostatique (voir figure 13). La grille avec les coupes est conservée dans un Dewar contenant de l’azote liquide. Enfin on réalise le transfert sous azote liquide dans le porte-objet cryogénique pour réaliser l’analyse en cryo-EM, voir figure 13.
Cette méthode, comme son nom l’indique, a été développée par Tokuyasu.47 Elle permet de congeler rapidement à très basse température des échantillons biologiques. Elle s’applique pour des localisations fines de molécules (protéines ou acides nucléiques) au sein d’un tissu ou des cellules à l’échelle nanométrique. La partie la plus intéressante pour nos préparations a été l’utilisation d’une solution sucrée saturée, dénommée « sucrose » dans la littérature, pour récupérer les sections, car cette solution à un temps de congélation relativement lent en fonction de la température, à titre d’exemple 2 secondes à -140°C.48 La solution saturée de saccharose a été obtenue avec une concentration de 2,3 M dans l’eau distillée.
Donc cette méthode ne nécessite pas l’utilisation d’un champ électrostatique pour garder les sections en lévitation (CEMOVIS) et cela a pour conséquence de réduire les difficultés de récupération des coupes. En effet, les sections glissent le long du couteau diamant et sont récupérées à l’aide d’une goutte de sucrose suspendu à une grille de MET, comme décrit dans la figure 13. L’intervalle de températures de travail pour nos études est beaucoup plus large de –40°C à –140°C alors qu’il est, pour les échantillons biologiques, que de –110°C à –140°. Cependant, il n’est pas possible de travailler dans tous les cas à la température de l’azote car l’utilisation du sucrose pour récupérer les sections ne serait plus possible, sa congélation étant presque immédiate. À –140°C, cette solution met environ 2 secondes pour durcir, donc lors de la récupération des sections nous devons être très rapide. Nous utilisons beaucoup cette technique pour réaliser des sections ultrafines (entre 50 et 90 nm d’épaisseur). Elle nous permet d’obtenir des sections ultrafines, sans artefacts et sans endommager le matériau.
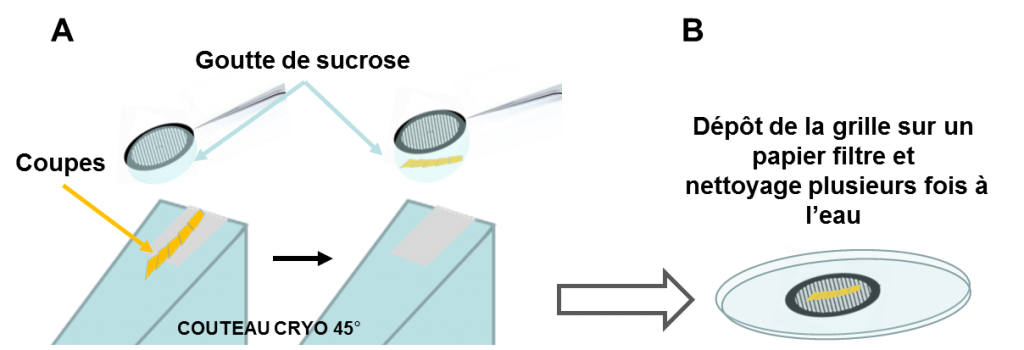
Dans la figure 14, nous présentons les différentes étapes de préparation. La première étape est commune à celle de la méthode CEMOVIS, nous congelons rapidement l’échantillon dans l’azote liquide. Nous fixons l’échantillon dans le bras du cryo-ultramicrotome et puis nous réglons la température de coupe. Les sections glissent le long de la paroi du couteau à chaque nouvelle coupe. Puis les sections sont rapidement collectées à l’aide d’une goutte de sucrose sur la grille de MET par l’attraction due à la tension de surface de la goutte. Ensuite cette grille est ramenée à température ambiante et déposée sur un papier filtre. La dernière étape de préparation est le lavage à l’eau pour éliminer le saccharose. Enfin, nous pouvons soit l’observer directement en MET standard, soit passer par l’étape de vitrification et réaliser les analyses par Cryo-EM pour les échantillons sensibles aux électrons.
